不同动物酒精性心肌病模型饲料
和模型复制方法
酒精性心肌病(ACM)
模型饲料和造模方法介绍
Alcoholic Cardiomyopathy Animal Model (ACM Model) and Diet
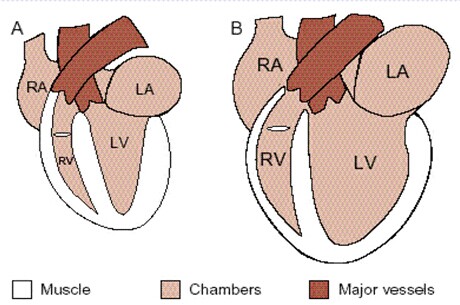 左:正常心脏的收缩期末;
左:正常心脏的收缩期末;右:扩张型心肌病心脏收缩期末。
酒精性心肌病(alcoholic cardiomyopathy, ACM)是酒精对心脏长期作用的归属,属于扩张性心肌病(dilated cardiomyopathy, DCM),也属于代谢性心肌病(metabolic cardiomyopathy)。表现为心肌肥厚,心室肌收缩力下降,心输出量减少,炎症,纤维化,但是,这种疾病几乎不发展到心衰阶段。
怎样针对酒精这个因素建立动物模型呢?欢迎你继续往下阅读。
酒精性心肌病模型
(Alcoholic Cardiomyopathy Animal Model)【摘要】本文介绍了过去和当前对酒精性心肌病模型复制的总体情况,不同实验动物中研究的情况评价。研究者应当特别注意动物选择和酒精给予的方法和喂养方法,以保障模型来自酒精的原发作用。
【关键词】心肌病模型复制;酒精性心肌病;模型饲料;实验动物
酒精性心肌病(alcoholic cardiomyopathy, ACM)是一种扩张性心肌病(dilated cardiomyopathy,DCM),表现为心肌肥厚,心室肌收缩力下降,心输出量减少,炎症,纤维化。饮酒患者ACM可能与以下因素有关:(1)酒精(或酒精代谢产物乙醛:acetaldehyde)对心肌的毒性;(2)饮酒习惯导致的营养素缺乏(例如维生素B1、锌缺乏)导致心脏功能改变;(3)酒精饮料中某些成分(例如钴摄入过多)的毒性。
我们是要建立“酒精性”的心肌病动物模型,而不是“饮酒者的”心肌病的动物模型,因此,关键是要确定该模型是酒精的原发作用,而不能掺杂上述的可能的原因(2)和(3)。
然而,迄今为止的涉及ACM动物造模的论文中,有些研究号称“酒精性心肌病”模型或者“alcoholic cardiomyopathy”,实际采用的研究方法不当或者没有控制好模型饲料,使得研究中掺杂了营养摄入不足的因素。
虽然已经在不同动物中进行了ACM造模及机制的研究,但是,迄今为止,没有任何一种动物模型能够比较满意地复制出人类的ACM,其原因一是人类的酒精性心肌病的发病原因可能很复杂,二是实验动物的心脏与人类心脏差别较大,尤其是对酒精的敏感性和酒精的代谢差异可能存在差别,三是模型方法本身需要探讨。
迄今为止,已经进行ACM造模的采用实验动物包括大鼠、小鼠、兔、狗、鸡、火鸡、猴。下面,分别介绍造模情况。
一、不同实验动物用于酒精性心肌病的研究情况
 大鼠
大鼠1.大鼠用于酒精对心脏的研究:
大鼠能否形成酒精性心肌病(Rat Alcoholic Cardiomyopathy)曾经有激烈争论,而今该模型已经广泛应用。大鼠ACM的模型复制的不足是,难以形成纤维化,如果必需要此表现,可以采用LPS注射的方法促进纤维化。关于大鼠ACM模型的造模方法和注意事项,请见:大鼠酒精性心肌病模型复制方法。
 C57BL/6小鼠
C57BL/6小鼠2.小鼠用于酒精对心脏的研究:
小鼠虽小,但模型建立方法似乎比较容易。C57BL小鼠和balb/c采用酒精液体饲料喂养后ACM模型表现为心肌发生炎性细胞浸润、肥厚、心脏功能改变和心肌纤维化。此外,ADK过表达小鼠和金属硫蛋白基因敲除小鼠(metallothionein-knockout mice,MT-KO mice)也都用于ACM发生机制的研究。关于小鼠进行ACM造模的方法和注意事项,请见:小鼠酒精性心肌病模型复制方法。
3.兔用于酒精对心脏的研究:
3kg左右的公兔饮用含酒精40%的水,连续21天,发生心肌肥厚,收缩能力下降,等容收缩期和等容舒张期均延长,血压降低,心肌内脂肪溶解,酸性脂质堆积。在该论文发表时隔2年,即1982年有一篇论文观察到,20%酒精给兔灌胃3周,心肌没有任何改变,但心脏毛细血管内皮细胞发生改变,认为这可能是心脏慢性缺氧所致毛细血管内皮细胞发生分化。
评价:以上2篇论文采用的动物都是兔,酒精浓度都是20%,但是,研究结果不同。读者应当注意两个方面存在的问题,一是酒精灌胃或者饮水中添加酒精都不是研究酒精性慢性疾病的理想方法,研究结果的可重复性差,二是要注意关于兔的ACM研究,除了此2篇,没有搜索到其他类似研究。
4.狗用于酒精对心脏的研究:
雄狗饮用水中加40%酒精(占饮食热量36%)22个月后,心脏功能发生改变,然而,没有见到心肌的炎症、肥厚和纤维化。后来,有一篇论文研究中狗暴露酒精长达29个月后,心脏收缩性下降,最大收缩速度降低,心肌摄取钙和肌浆网结合钙均减少。
评价:对于狗进行ACM研究,文献中采用饮水中加酒精的方法,这是不可取的,因为难以控制营养因素。例如,在上面的一个例子中,酒精热量占饮食热量的36%,虽然研究中能够控制好总热量摄入,但是无法控制营养素的摄入量,尤其是维生素和矿物质,除非每天根据热量摄入来计算和额外补充维生素和矿物质,否则营养素缺乏或不足的情况难以避免,所谓“alcoholic”也就要打问号。
5.鸡用于酒精对心脏的研究:
采用含酒精浓度20%的水给成年鸡灌胃12周,心肌细胞肥大、心肌溶解、纤维化和心衰表现。
评价:该方法至今没有文献引用。该方法的不足之处是“饮水中给酒精”带来的弊端。
6.火鸡用于酒精对心脏的研究:
饮水中加入5%酒精(占饮食热量的25%)喂56天发生类似人类ACM。
评价:该方法至今没有文献引用。该方法的不足之处是“饮水中给酒精”带来的弊端。
7.猴子用于酒精对心脏的研究:
猕猴(cynomolgus)和恒河猴(rhesus)的饮水中添加酒精,每天饮用酒精的量是1.5g/kg体重和3.3g/kg体重,12个月后心肌活检,观察到心肌发生类似人类的ACM早期表现。
评价:应用灵长类动物优点很明显,但研究很少。该文献采取的方法是“饮水中给酒精,这种方法存在弊端,并且与酒精液体饲料法相比并不轻松。
二、心脏功能评估方法
1. 心动超声定量分析心脏解剖和心功能测定
这是比较理想的方法。可以在体评估心脏功能(心输出量,搏出量,心率,等等)和心脏解剖(心脏大小、心室大小、心室壁的厚度,室中膈的厚度等等)。然而,小鼠的心脏小,需要超声波仪器设备,特别是需要购置配套的特殊探头,因此,对实验室装备要求高。正因为如此,有的研究论文中只采用了离体心脏观察。
2. 离体心脏灌流法观察心脏功能。
这是可取的方法,尤其是在没有心动超声的情况下,可以更清楚地观察心脏功能。没有研究基础的研究者可能感觉到该方法不难,没有研究基础的研究者可以向生理、病理生理或药理教研室的教师们获得帮助。
3. 离体细胞培养分析
在造模后,取心室肌样品,分离心肌细胞,细胞孵育后进行离体测定,包括基础状态、电刺激、儿茶酚胺类刺激时心肌长度、收缩速度(速率)、舒张速度(速率)和收缩力的改变,等等。
4. 心脏重量、形态学、生化和分子生物学方法测定
由于发生水肿,心脏重量应当干重。由于心脏重量与体重有关,应当采用干重/体重指标进行组间比较。
形态学观察包括大体和组织细胞观察,大体观察包括心室壁和室中膈的厚度等方面的测量。组织学观察包括心肌细胞横截面的面积(反映心肌细胞肥大)、水肿、炎症、心肌细胞溶解、纤维化等,电镜下观察超微结构的改变。
【参考文献】
- Mall G, Mattfeldt T, Rieger P, Volk B, Frolov VA. Morphometric analysis of the rabbit myocardium after chronic ethanol feeding - early capillary changes. Basic Res Cardiol. 1982 Jan-Feb;77(1):57-67
- Frolov VA, Dvornikov VE, Kazanskaia TA, Pukhlianko VP, Savastenko AE. Morphofunctional features of the left ventricle of rabbits with experimental alcoholic cardiomyopathy. Biull Eksp Biol Med. 1980 Mar;89(3):358-60.
- Timothy J. Regan, Mohammad I. Khan, Philip O. Ettinger, Bunyad Haider, Michael M. Lyons, Henry A. Oldewurtel, Marilyn Weber Myocardial function and lipid metabolism in the chronic alcoholic animal. J Clin Invest. 1974 September; 54(3): 740–752.
- Sarma JS, Ikeda S, Fischer R, Maruyama Y, Weishaar R, Bing RJ. Biochemical and contractile properties of heart muscle after prolonged alcohol administration. J Mol Cell Cardiol. 1976 Dec;8(12):951-72.
- Yuan L, Li WM, Jing L and Zhou LJ. Effect of carnitine on serum cholesterol of alcoholic cardiomyopathy dogs. Eur J Lipid Sci Technol 2010, 112: 821–827.
- Cheng CP, Cheng HJ, Cunningham C, Shihabi ZK, Sane DC, Wannenburg T, Little WC. Angiotensin II type 1 receptor blockade prevents alcoholic cardiomyopathy. Circulation. 2006 Jul 18;114(3):226-36.
- Morris N, Kim CS, Doye AA, Hajjar RJ, Laste N, Gwathmey JK. A pilot study of a new chicken model of alcohol-induced cardiomyopathy. Alcohol Clin Exp Res. 1999 Oct;23(10):1668-72.
- Noren GR, Staley NA, Einzig S, Mikell FL, Asinger RW. Alcohol-induced congestive cardiomyopathy: an animal model. Cardiovasc Res. 1983 Feb;17(2):81-7.
- Cheng HJ, Grant KA, Han QH, Daunais JB, Friedman DP, Masutani S, Little WC, Cheng CP. Up-regulation and functional effect of cardiac β3-adrenoreceptors in alcoholic monkeys. Alcohol Clin Exp Res. 2010 Jul;34(7):1171-81.
- Rossi MA. Alcohol and malnutrition in the pathogenesis of experimental alcoholic cardiomyopathy. J Pathol. 1980 Feb;130(2):105-16.
- Liu CY, Guan Z, Eskelson CD. Cardiac function in rats exposed to chronic alcohol and nutritional deficiency involving selenium and vitamin E. J Appl Res. 2014,4(3):427-438.
---------《》-------
 可以任意缺乏或过载某营养素
可以任意缺乏或过载某营养素
 可以任意添加药物或测试成分
可以任意添加药物或测试成分
 可以精确定量饲料摄入量
可以精确定量饲料摄入量
 可以任意定制饲料
可以任意定制饲料
- AIN76酒精液体饲料(TP4000)
- AIN93G酒精液体饲料(TP4010)
- AIN93M酒精液体饲料(TP4020)
- 标准型Lieber-DeCarli酒精液体饲料(TP4030)
- 43%高脂肪型Lieber-DeCarli酒精液体饲料(TP4039)
- 12%低脂型Lieber-DeCarli酒精液体饲料(TP4032)
- 10%低脂肪型Lieber-DeCarli酒精液体饲料(TP4031)
- 5%低脂型Lieber-DeCarli酒精液体饲料(TP4033)
- 2%低脂型Lieber-DeCarli酒精液体饲料(TP4034)
- 25%高蛋白型Lieber-DeCarli酒精液体饲料(TP4035)
- 12.5%低蛋白型Lieber-DeCarli酒精液体饲料(TP4036)
- 4%低蛋白型Lieber-DeCarli酒精液体饲料(TP4038)
- 2%低蛋白型Lieber-DeCarli酒精液体饲料(TP4037)
- 26%酒精Rao-Larkin酒精液体饲料(TP4063)
- 40%酒精高脂Nanji液体饲料(TP4054)
- 29%酒精高脂Nanji液体饲料(TP4062)
- Lindros酒精液体饲料(TP4060)
- Lieber-DeCarli酒精液体饲料25%高蛋白型
- Weinberg-Keiver酒精液体饲料(TP4040)
- Yeh-Cerklewski酒精液体饲料(TP4100)
- Sahchis酒精液体饲料(TP4230)
- Wiener酒精液体饲料(TP4200)
- Tsukamoto-French模型酒精液体饲料
- Thompson-Reitz酒精液体模型饲料(TP5100)
- Badger酒精液体饲料
- 微型猪(小型猪)酒精液体饲料
- 灵长类Lieber-DeCarli酒精液体饲料(TP7000)
