TP4032:12%低脂型Lieber-DeCarli酒精液体模型饲料
Lieber-DeCarli Ethanol Liquid Diet(low fat 12%,TP4032)
一、12%低脂型Lieber-DeCarli ethanol liquid diet介绍
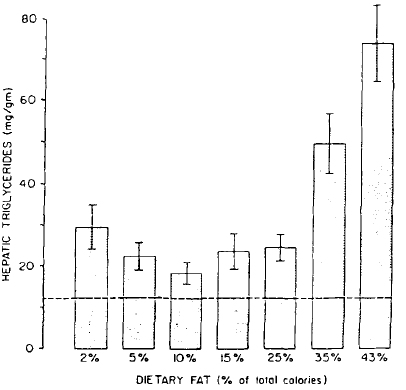
Effect of varying amounts of dietary fat on hepatic fat accumulation produced by ethanol. Hepatic triglycerides were measured in seven groups of rats given ethanol (36% of calories) with a diet of normal protein) content. Average hepatic triglyceride concentration in the control animals is indicated by a dotted line.
Lieber-DeCarli标准型中脂肪热量是35%,根据Lieber和DeCarli两位研究者的研究,当脂肪热量低于15%时,肝脏中甘油三酯沉积的程度最低,如图所示。因此,12%脂肪的酒精液体饲料是常用于除了脂肪肝造模之外的各种酒精效应的理想的酒精液体饲料。
由于Lieber-DeCarli是以标准型(regular type)来衡量其他液体饲料的类型,12%脂肪水平低于标准型中的35%水平,这才称为低脂型。实际上,在成年大鼠或小鼠的正常饲料(普通饲料)中脂肪热量12%属于正常范围,能够满足这些动物的营养需要。因此,Lieber-DeCarli液体饲料中低脂12%实际上处于正常脂肪含量,不要误认为这是脂肪酸供应不足的低脂饲料。
然而,必需要考虑的是,幼年大鼠或小鼠对饲料脂肪的需要量是在17%~20%,最低不应该低于13%,很明显,12%脂肪的饲料是典型的低脂低热量的饲料。
脂肪12%,蛋白质18%,碳水化合物34%, 酒精36%。
南通特洛菲饲料科技有限公司生产的该模型饲料的代码:TP4032;
【2】低脂型Lieber-DeCarli酒精液体对照饲料:脂肪12%,蛋白质18%,碳水化合物70%。
南通特洛菲饲料科技有限公司生产的该对照饲料的代码:TP4032C;
二、TP4032低脂型Lieber-DeCarli ethanol liquid diet的用途
该低脂型模型饲料特别适用于:
1. 酒精性脂肪肝之外所有方面的研究,包括酒精性肝损伤、酒精对其他器官的作用、其他器官疾病模型复制。
2. 作为幼年大鼠或小鼠的低脂酒精液体饲料。
3. 作为成年动物标准型酒精液体饲料的低脂对照。
(1)作为标准型LD酒精液体饲料的低脂对照;
(2)用于研究脂肪摄入不高的情况下酒精的生理效应、毒性效应、成瘾现象和机理、戒断症状和机理;
(3)酒精性肝损伤模型的复制;
(4)酒精性胰腺炎模型的复制
(5)药物、食品功能因子、保健食品对酒精性脂肪肝的对抗作用;
(6)药物、食品功能因子、保健食品对酒精的解毒作用;
(7)酒精与毒素(环境、食物、微生物的毒素)对机体的相互作用。
请注意动物不同种系、品系、年龄、性别的差异。
三、TP4032低脂型Lieber-DeCarli ethanol liquid diet应用的注意点
TP4032是脂肪热量为12%低脂型Lieber-DeCarli酒精液体模型饲料,而TP4031也是低脂型,脂肪热量是10%。在选择时,研究者可根据自己的兴趣和科研的具体情况而定,一般情况下,两者可以任选。
如果希望脂肪热量再低一些,可以采用5%低脂型,或者更低的2%极低脂肪型Lieber-DeCarli酒精液体饲料。
关于Lieber-DeCarli酒精液体模型饲料的详细介绍,请点击“Lieber-DeCarli酒精液体饲料和注意事项”。
请特别注意:
1.购买饲料前:
(1)应当做好动物的准备,注意动物的品种、品系、年龄、性别的选择。
(2)准备好喂养流程的准备。
2. 购买后应当及时向公司索取以下资料:
《液体饲料配制方法》
《酒精液体饲料喂养方法》
《怎样根据研究的需要调整酒精的配比》
References:
Siggins RW, Melvan JN, Welsh DA, Bagby GJ, Nelson S, Zhang P. Alcohol suppresses the granulopoietic response to pulmonary Streptococcus pneumoniae infection with enhancement of STAT3 signaling. J Immunol. 2011 Apr 1;186(7):4306-13.
Jeong WI, Osei-Hyiaman D, Park O, Liu J, Bátkai S, Mukhopadhyay P, Horiguchi N, Harvey-White J, Marsicano G, Lutz B, Gao B, Kunos G. Paracrine activation of hepatic CB1 receptors by stellate cell-derived endocannabinoids mediates alcoholic fatty liver. Cell Metab. 2008 Mar;7(3):227-35.
Bradford BU, O'Connell TM, Han J, Kosyk O, Shymonyak S, Ross PK, Winnike J, Kono H, Rusyn I. Metabolomic profiling of a modified alcohol liquid diet model for liver injury in the mouse uncovers new markers of disease. Toxicol Appl Pharmacol. 2008 Oct 15;232(2):236-43.
Zhong Z, Connor HD, Mason RP, Lemasters JJ, Thurman RG. Ethanol, not fat accumulation per se, increases free radical production in a low-flow, reflow liver perfusion model. Transplantation. 1998 Dec 15;66(11):1431-8.
Mukhopadhyay B, Liu J, Osei-Hyiaman D, Godlewski G, Mukhopadhyay P, Wang L, Jeong WI, Gao B, Duester G, Mackie K, Kojima S, Kunos G. Transcriptional regulation of cannabinoid receptor-1 expression in the liver by retinoic acid acting via retinoic acid receptor-gamma. J Biol Chem. 2010 Jun 18;285(25):19002-11.
Singh M. Effect of chronic ethanol feeding on factors leading to inappropriate intrapancreatic activation of zymogens in the rat pancreas. Digestion. 1992;53(1-2):114-20.
Slukvin II, Boor PJ, Jerrells TR. Initiation of alcoholic fatty liver and hepatic inflammation with a specific recall immune response in alcohol-consuming C57Bl/6 mice. Clin Exp Immunol. 2001 Jul;125(1):123-33.
Ringseis R, Muschick A, Eder K. Dietary oxidized fat prevents ethanol-induced triacylglycerol accumulation and increases expression of PPARalpha target genes in rat liver. J Nutr. 2007 Jan;137(1):77-83.
Dalton SR, Wiegert RL, Baldwin CR, Kassel KM, Casey CA. Impaired receptor-mediated endocytosis by the asialoglycoprotein receptor in ethanol-fed mice: implications for studying the role of this receptor in alcoholic apoptosis. Biochem Pharmacol. 2003 Feb 15;65(4):535-43.
Singh M. Effect of chronic feeding of ethanol diet of "average" fat content on rat pancreas. Dig Dis Sci. 1987 Jan;32(1):57-64.
LaSure MM, Perez-Jimenez F, Singh M. Interaction of chronic alcohol administration and diet on pancreatic acinar cell metabolism in the rat. Dig Dis Sci. 1986 Oct;31(10):1073-80.
Vonlaufen A, Wilson JS, Pirola RC, Apte MV. Role of alcohol metabolism in chronic pancreatitis. Alcohol Res Health. 2007;30(1):48-54.
Singh M. Role of Alcohol in the Development of Chronic Pancreatitis. Chronic Pancreatitis. 1990, pp 140-143.
Clugston RD, Yuen JJ, Hu Y, Abumrad NA, Berk PD, Goldberg IJ, Blaner WS, Huang LS. CD36-deficienct mice are resistant to alcohol- and high-carbohydrate-induced hepatic steatosis. J Lipid Res. 2013 Nov 26.
Reinke LA, Lai EK, DuBose CM, McCay PB. Reactive free radical generation in vivo in heart and liver of ethanol-fed rats: correlation with radical formation in vitro. Proc Natl Acad Sci U S A. 1987 Dec;84(24):9223-7.
Hartman AD, Di Luzio NR. Inhibition of the chronic ethanol-induced fatty liver by antioxidant administration. Proc Soc Exp Biol Med. 1968 Jan;127(1):270-6.
---------《》-------
 可以任意缺乏或过载某营养素
可以任意缺乏或过载某营养素
 可以任意添加药物或测试成分
可以任意添加药物或测试成分
 可以精确定量饲料摄入量
可以精确定量饲料摄入量
 可以任意定制饲料
可以任意定制饲料
- AIN76酒精液体饲料(TP4000)
- AIN93G酒精液体饲料(TP4010)
- AIN93M酒精液体饲料(TP4020)
- 标准型Lieber-DeCarli酒精液体饲料(TP4030)
- 43%高脂肪型Lieber-DeCarli酒精液体饲料(TP4039)
- 12%低脂型Lieber-DeCarli酒精液体饲料(TP4032)
- 10%低脂肪型Lieber-DeCarli酒精液体饲料(TP4031)
- 5%低脂型Lieber-DeCarli酒精液体饲料(TP4033)
- 2%低脂型Lieber-DeCarli酒精液体饲料(TP4034)
- 25%高蛋白型Lieber-DeCarli酒精液体饲料(TP4035)
- 12.5%低蛋白型Lieber-DeCarli酒精液体饲料(TP4036)
- 4%低蛋白型Lieber-DeCarli酒精液体饲料(TP4038)
- 2%低蛋白型Lieber-DeCarli酒精液体饲料(TP4037)
- 26%酒精Rao-Larkin酒精液体饲料(TP4063)
- 40%酒精高脂Nanji液体饲料(TP4054)
- 29%酒精高脂Nanji液体饲料(TP4062)
- Lindros酒精液体饲料(TP4060)
- Lieber-DeCarli酒精液体饲料25%高蛋白型
- Weinberg-Keiver酒精液体饲料(TP4040)
- Yeh-Cerklewski酒精液体饲料(TP4100)
- Sahchis酒精液体饲料(TP4230)
- Wiener酒精液体饲料(TP4200)
- Tsukamoto-French模型酒精液体饲料
- Thompson-Reitz酒精液体模型饲料(TP5100)
- Badger酒精液体饲料
- 微型猪(小型猪)酒精液体饲料
- 灵长类Lieber-DeCarli酒精液体饲料(TP7000)
