II型糖尿病模型(T2DM模型)
II型糖尿病模型饲料与复制糖尿病模型方法
糖尿病II型(T2DM, NIDDM)是胰岛素抵抗(insulin resistance,IR)发展所致的疾病。复制II型糖尿病模型,首先要弄清楚这种疾病的关键:
T2DM是外周胰岛素抵抗发生后,胰岛β细胞增强胰岛素分泌,导致高胰岛素血症,继而发展为胰岛β细胞代偿功能不足,引起空腹血糖升高。
正确立理解上句话的含义,我们就能理解T2DM造模的以下核心要点:
(1)动物模型中必需出现胰岛素抵抗,外周血浆表现为高胰岛素血症。
(2) 胰岛β细胞分泌胰岛素的能力下降。
(3) 空腹高血糖,并且高血糖发生在胰岛素抵抗进展之后。
因此,我们必需清楚:
(1) β细胞代偿功能不足是糖尿病的关键特征。
(2) 任何辅助手段建立T2DM时,如果不是在胰岛素抵抗形成并且得到维持的情况下导致的高血糖不是T2DM。
(3) T2DM应当是胰岛素抵抗和高血糖,但是,高血糖的程度应当是比较温和的,如果是胰岛素抵抗伴有严重的高血糖,则不符合人类T2DM的特点。
II型糖尿病模型与饲料
(Type II Diabetes model and model diet )【摘要】本文介绍了II型糖尿病模型的复制方法,包括单纯地饲料诱导和药物辅助的模型饲料诱导。单纯地饲料诱导,主要适用于金黄地鼠、沙鼠和C57BL/6J小鼠,其他动物一般需要药物辅助。文中对药物辅助的方法和注意点做了详细介绍。在其后的内容中强调,做II型糖尿病模型,应当确认是否是II型。
【关键词】糖尿病模型;模型饲料;实验动物
II型糖尿病是在胰岛素抵抗基础上,发展成胰岛β细胞功能衰竭时出现的血糖升高。按道理,II型糖尿病模型与胰岛素抵抗模型应该是相同的复制方法,只需要延长时间。其实不然,因为大多数动物可以出现胰岛素抵抗,但因为β细胞功能强大,对抗II型糖尿病的能力很强,天生不容易发展到β细胞功能衰竭而出现血糖改变。因此,II型糖尿病模型,与胰岛素抵抗模型不完全是一回事。下面,让我们来看看怎样做。
一、单纯用饮食诱导的2型糖尿病模型和模型饲料
用饲料来诱导2型糖尿病的模型并不多,原因是,绝大多数动物的胰岛具有天然的对抗能力,即便是能够产生胰岛素抵抗和血浆胰岛素水平很高,也很难到达餐后高血糖的地步,如果你还希望达到空腹血糖升高的程度,很难,几乎不可能!那么,哪些正常动物能够诱导比较满意的2型糖尿病模型呢,下面就来看看。
1.金黄色地鼠II型糖尿病模型
模型饲料:FFC饲料。
模型评价:体重100克左右的金黄地鼠,喂养6-22周后出现糖尿病(空腹血糖升高),并有严重的脂肪肝。
2.沙鼠II型糖尿病模型
模型饲料:高热量饲料。
模型评价:在野外抓取的沙鼠,或者实验室饲养的沙鼠(预先要检查饲料的热量、血糖),要预先对用相对高热量的饲料喂养,出现摄食过量,胰岛素抵抗,高胰岛素,继而胰岛功能衰减,可因酮症而出现至死性贫血。
3.C57BL/6J小鼠II型糖尿病模型
C57BL/6J小鼠见右边图片。

模型饲料:高脂饲料。
模型评价:喂养C57BL/6J后食量增加,1周内开始肥胖,1周后血糖升高,一直维持到12个月(轻到中度高血糖)。血浆胰岛素随时间升高,1周后糖耐量试验阳性,胰岛素抵抗。该模型属于早期的II型糖尿病模型。
二、β细胞破坏辅助饮食诱导的II型糖尿病模型
由于大多数动物不容易产生胰岛素相对不足,在给予高糖饲料的同时,需要采取辅助措施:破坏β细胞。
模型原理:用药物破坏一部分β细胞,使得正常β细胞减少,从而承受着血糖调节的重担,这就逐渐衰竭,血液中的胰岛素出现相对不足,从而发生II型糖尿病。
1. 不要把模型造错了:把II型糖尿病复制成了I型糖尿病!
I型糖尿病和II型糖尿病的最大区别在于,I型的诱导β细胞大幅减少,胰岛素分泌少,血浆中胰岛素绝对不足,而II型仍有比较多的胰岛素分泌,但血浆中胰岛素处于相对不足。在破坏一部分β细胞来建立II型糖尿病时,破坏β细胞的量非常关键,如果破坏过多,那就成了I型糖尿病了。有些研究者忽视了注意点,只是关心血糖是不是升高,结果自认为是在研究II型,实际上是研究I型。有的研究者曾经遇到这样的困惑:投递的论文稿件后被退回,理由是糖尿病的模型错误或不科学。
2. 链脲霉素(STZ)和四氧嘧啶ALX给药方法
链脲霉素(Streptozotocin,streptozocin,STZ,又叫链唑霉素)和四氧嘧啶(alloxan,ALX)是II型糖尿病常用的两种辅助工具药物,了解用法非常重要。不少研究者只顾使用,不知道其中应当有讲究。请继续往下阅读。
首先,要注意两种药物给药途径有讲究。
至于药物的使用剂量应该多大,文献中都有介绍,如果不清楚,可以与我们技术部联系。
3. 链脲霉素(STZ)和四氧嘧啶ALX使用哪一个?
要注意兔和豚鼠有不同:
---兔:只能使用ALX,不宜使用STZ。因为他的β细胞对STZ不敏感。
---豚鼠:只能使用STZ,不宜使用ALX,因为他的β细胞ALX不敏感。
虽然绝大多数动物都可以使用STZ和ALX,但是,ALX有很多缺点,大有被STZ取代之势。
三、怎么知道模型成功,怎么知道是II型糖尿病模型
建立II型糖尿病模型,必需确认是不是II型。那么,怎样确认呢?下面的两张图片是从文献中切取下来供读者了解的。
首先,糖耐量试验是必做的。从下图可以看到,糖耐量试验表明糖耐量试验不正常。
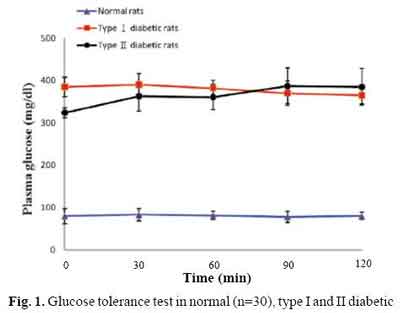
再来看胰岛素-葡萄糖关系,请看下图。
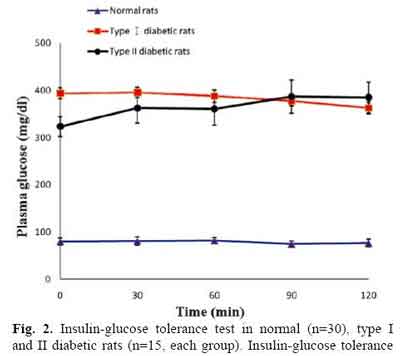
上面两图是某文献中对STZ注射后的大鼠做的,红线条是大剂量注射的(I型糖尿病模型),黑线条是低剂量的(II型糖尿病模型)。你从上图中(Fig1)糖耐量试验的结果,下图(Fig2)中胰岛素-糖耐量试验的结果,你看到有差别吗?
四、辅助降血糖功能评价方法
这里介绍由国家食品药品监督管在2012年4月23颁布的保健功能评价方法中关于辅助降血糖功能评价方法的模型。
成年动物,适应1天后,随机取15只动物禁食3-5小时,测空腹血糖,作为该批次动物基础血糖值。随后动物禁食24小时(自由饮水),注射四氧嘧啶(用前新鲜配制)造模,小鼠45-50mg/kg BW.iv或125-130mg/kg BW.ip,大鼠50-80mg/kg BW.iv或120-160mg/kg BW.ip。5-7天后动物禁食3-5小时,测血糖,血糖值10-25mmol/L为高血糖模型成功动物。
具体方法:《附件3 辅助降血糖功能评价方法》(点击下载pdf文档)。
►高脂饮食或模型复制的研究者请注意:
一篇SCI论文总结了高影响因子(IF)期刊发表的论文所用的高脂模型饲料情况,提供了惊人的数据:
对照组饲料类型设计合理只有14%,其余86%的研究论文中都有问题!敬请读者:点击阅读。
►各著名企业西方饮食造模饲料代码对照表
